川崎洸司特別研究員、深谷雄志准教授(ともに東大定量生命科学研究所)らは、エンハンサー領域が転写因子の局所的濃度変化を介して二つの遺伝子発現を協調的に制御する機構を明らかにした。成果は現地時間5月18日付で米科学雑誌『Molecular Cell』誌に掲載された。
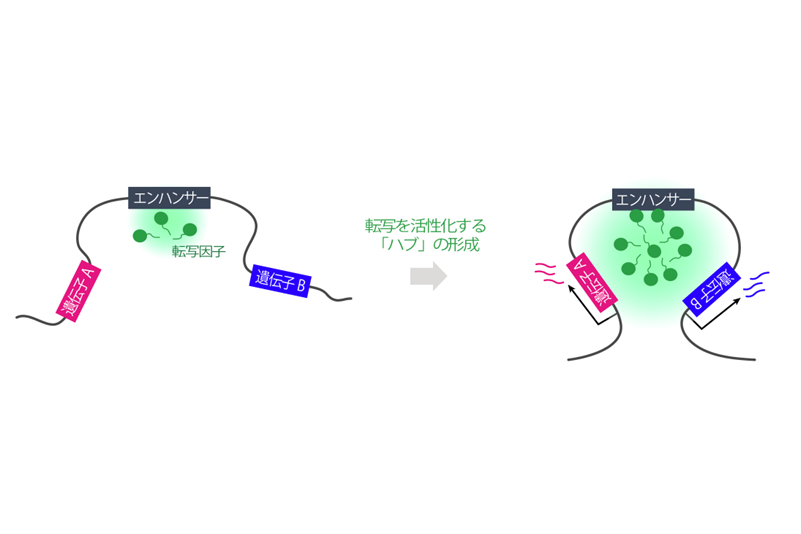
これまでDNA上の領域であるエンハンサーは、転写開始を担う領域のプロモーターと安定なループ構造を形成し、転写が活性化されると考えられてきた。ところが近年、エンハンサーが、近辺で転写因子(転写に関わるタンパク質群)が濃縮する「反応場」として機能して転写が活性化される新たなモデルが提唱されていた。ただ、反応場と転写活性との機能的な因果関係や、エンハンサーが反応場をいかに形成するかは不明だった。
川崎研究員らのグループは、任意の転写因子を特定のゲノム領域に留めるシステムを確立。転写ライブイメージング技術と組み合わせ、ショウジョウバエ初期胚でのエンハンサーを介した転写活性化の過程をリアルタイムで観察することにも成功した。
解析の結果、転写因子はエンハンサー上で集合と離散を繰り返し、反応場が形成される標的遺伝子から転写が起こることが分かった。さらに、反応場は同じDNA上に離れて存在する二つの遺伝子領域で共有され、同調的に転写が進行することも判明。エンハンサーが形成する「反応場」が、転写を活性化するためのハブとしても機能するという、新たな遺伝子発現機構の存在が示唆された(図)。
成果は長年未解明だったエンハンサーによる転写誘導の分子機構の解明につながるほか、遺伝子の発現を人為的に操作するためのゲノム技術の開発や、がんなどの疾患発症機構の解明への貢献が期待される。










