東京大学教養学部化学部寄稿連載「東大入試から学ぶ化学」
(寄稿=東京大学教養学部化学部)
こんにちは! 東京大学教養学部所属の田中健太と申します。今回は前回と変わって私が記事を執筆いたします。よろしくお願いいたします。
さて、2回目の今回は有機化学の問題でかなりの頻度で出てくる「ヨードホルム反応」を電子の流れという観点から見ていきたいと思います! まずは実際にこの反応を問われた入試問題を見ていきましょう。
【問題】2020年第1問Ⅱより抜粋
水中でアセトンに過剰量の水酸化ナトリウムとヨウ素を反応させると,特有の臭気を有する黄色の化合物Iが沈殿し,反応液中に酢酸ナトリウムが検出された。
問キ 化合物Iの分子式を示せ。
【解答】
CHI3
(解答は東京大学教養学部化学部が作成)
【考察】
ヨードホルム反応を知っていて、なおかつその生成物を覚えていればとても簡単な問題ですね! しかしながら、この問題の答えが分かったよ〜という読者の方の中でも、この反応のメカニズムを答えられるという方は少数派だと思います。私自身、現役時代は丸々暗記していました。しかし、それではただの暗記でつまらないですよね! そこで、ここでは電子がどのように移動していくのかに着目しつつ、ヨードホルム反応を段階的に追っていきたいと思います。
……とその前に、極力暗記なしにヨードホルム反応を理解するにはある程度の予備知識が必要になってくるので、まずはその解説となります! 最後にクイズもつけたので是非挑戦してみてくださいね(^^)/
§1 軌道
軌道という言葉を聞いたことがあるよ〜という読者の方は結構多いのではないでしょうか。ヨードホルム反応の説明に必要な部分だけざっくりと説明します。突然ですが電子を思い浮かべてください! おそらく多くの読者の方は、球の姿をした電子を今思い浮かべているのではないでしょうか。まさに負の電荷がギュッと一点に凝縮しているようなイメージだと思います。
一方で大学の講義では、電子を空間的に広がっているものとして扱うことが多いです。言葉だけ聞くと「???」という読者の方も多いかと思いますが、ざっくり言うと電子を雲のように捉えるということですね! 雲の白色が濃い部分には多くの水があるように、電子雲の濃い部分はより負の電荷を帯びている、といったイメージです。
さて、皆さんは雲の絵を描くときどのように表しますか? 私ならモクモクモクと、このように円弧を繋げて描くと思います(図1)。

しかし、よく考えてみると実際の雲に輪郭なんてありませんよね。あるのは白色の濃淡です。つまり、私は雲を描くときに「この濃さ未満の部分は空、以上の部分は雲」と境界線を決めて描いていたのです。もう少しきっちり言うと、例えば「H2Oが90%になる境界線」を「雲の形」と定義すると上のような図が描ける、といったところでしょうか。
軌道と聞くと何やらきっちりとした線や、レールのようなものを思い浮かべてしまいますが、電子はある直線の上、面の上にのみ存在するわけではありません。ちょうどH2Oが「雲の形」の上にしかないわけではなく空間に広く分布しているように、電子も空間にぼんやりと広がりを持って存在しているのです!
このセクションで是非覚えていただきたいのは「電子は空間的に広がりを持つ」ということでした。一箇所に局在しているわけではないのです!
§2 電気陰性度とルイス構造式
「有機化学の反応を理解する上で重要なものとは」と問われたら、皆さんは何と答えますか? 私なら「電子」と答えます! なぜかというと、化学反応の多くは酸化還元反応、つまり物質間で電子をやり取りする反応であり、電子の疎密と反応箇所とは深い関わりがあるからです。ということで、物質のどこに電子が集まっているかを手軽に知る方法があると便利なのですが……。
まず一つの方法として考えられるのは、電子の存在確率を計算することですね。先述の通り、大学の講義では電子を雲のように捉えます。そして電子という名の雲の形状と濃さを計算して出します。するとどこに電子が多いか少ないかが分かる、という仕組みです。
ではどうやって電子雲の形状、濃淡を計算するのか? その計算方法や考え方を大学の授業で習うのですが、その授業内容を私なりに一言でまとめるとするならば、ずばり「コンピューターがないと計算無理だね」ということです。でも、実際の試験場ではコンピューターを持ち込めないので困ってしまいますよね。
そこで役に立つのがもう一つの方法です。ここでは電気陰性度とルイス構造式を用います。まず電気陰性度についてですが、「電気陰性度は電子好き好き度である」と私は直観的に考えています! ある原子の電気陰性度の値が大きければ大きいほどその原子は電子が好き、つまり電子を欲しているということです。
そして、ルイス構造式というのは最外殻電子を点で表したものです。原子間にある電子は二つの原子で共有されていて、電子を共有することにより原子は結合を形成しています。「結合」を視覚的にわかりやすくするために、原子を価標と呼ばれる棒で繋ぐことも多々あります。例えば、これがHF;フッ化水素のルイス構造式です(図2)。

ここで、電気陰性度と電子式という概念を用いて「分極」という現象を説明してみましょう! 上の図を見ると、HFの間にある共有電子対はちょうどHとFの真ん中にあるように書かれていますよね。しかしながら、これは厳密には正しくありません。
FはHよりも電気陰性度の値が大きいです。ということは、FはHよりも電子が「好き」ということになります。好きなものにはなるべく自分のそばにいてほしいですから、実際には共有電子対はFの方に近くなっているのです(図3)。更に、共有電子対はFの方に偏っているので、Fの周りは電子が密であり電荷が少し負です。逆に、Hの周りは電子が疎であり電荷が少し正です。このように、コンピューターを使わなくてもざっくりとした電子の疎密が分かる(こともある)のです!
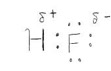
〈補足〉「『電子が好き』ってどういうこと!? 原子に感情なんてないでしょ!」と思われた読者の方もいらっしゃると思いますが、ここでの「好き」とは「電子に近くにいて欲しい」ということであり、なぜ近くに欲しいかというと「近くにいると自分がより安定になるから」です! そう考えると、ずいぶん利己的な好意ですね……。
§3 共鳴
ここでは共鳴という概念について説明したいと思います。量子化学では電子は非局在化しています。そしてより広い範囲で非局在化できた方がその物質は安定になります。ここではCO32-を例にとって解説します!
まず炭酸イオンのルイス構造式はこのようなものです(図4)。
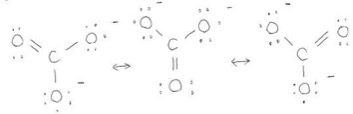
三つの酸素を区別すると3種類のルイス構造式が書けるのをお分かりいただけるでしょうか。これらの構造は互いに共鳴しています。平衡と見た目は似ていますが異なる点があります。それは何かというと、平衡は複数の種類の構造が混在していますが、共鳴は一つの構造に定まっているという点です。炭酸イオンの場合だと、全ての酸素原子がそれぞれ-2/3だけ負の電荷を帯びているイメージです!
このように、複数の構造式で共鳴している分子、イオンはより安定になります。その理由ですが、直感的なイメージで説明すると、炭酸イオンなら「負の電荷を二つの酸素で担うよりも三つの酸素で担う方が、一つ一つの負担が減るからより安定」といったところでしょうか。厳密な理由を提示すると量子力学、化学の話になるので今回は割愛します。
§4 電子の流れで化学反応を考える
本題に入る前に、どのようにこれまでの概念を用いて反応を考えるかを少しばかり練習してみましょう! 例えば塩酸の中には水素イオンが入っていますよね。普段は簡略化して
HCl→H++Cl–
と表記するかと思いますが、厳密に言うと水素イオンはそれ単独で存在しているわけではありません。実際は周りにある水分子と反応して
H++H2O→H3O+
のようにオキソニウムイオンの形で存在します。ではどのような反応のメカニズムなのか、それを電子の流れを追いながら確認していきたいと思います。
まず、全体としては電気的に中性なH2Oですが、局所的には電荷が正の部分と負の部分があります。さて、水分子の中で電子が密な部分はどこでしょうか? 是非ここで立ち止まって考えてみてください。
答えは酸素原子の周りです! なぜなら酸素原子は水素原子よりも電気陰性度が高い、すなわち電子が好きだからです! それ故、酸素原子は電子を自分の近くに寄せたがるのです。
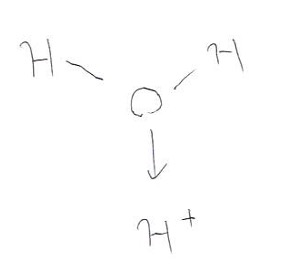
一方、水素イオンは全体としてすでに正の電荷を帯びていますから、水分子の酸素原子と水素イオンの間にクーロン力が働きます。「もし水素イオンと水分子が反応するとしたら水分子の酸素原子と水素イオンが結合を作るのだろうな〜」ということが電子の疎密からこのように分かるのです!
実際、水素イオンは空のK殻(量子化学では1s軌道)を持っていますから、水分子の酸素原子の非共有電子対がその空の電子殻に入って、配位結合を形成するのです(図5)。
ここで配位結合について少々。配位結合、名前は知っているけれど実際にはどう形成されるのかいまいちピンときていない、という読者の方もいらっしゃるのではないでしょうか?
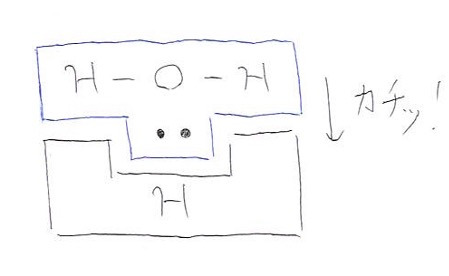
私の中では、配位結合はずばり「知育玩具のブロック」です! 組み立て遊ぶブロックって、凹凸を合わせることで繋げますよね。それと同じように原子が繋がることを配位結合と呼びます。原子の凹凸って何? となるかもしれませんが、ここでの凹みは空いている電子殻(軌道)のこと、出っ張りは非共有電子対のことです。このように見立てるとわかりやすいかもしれません(図6)。
おまけのクイズコーナー(^^)/
最後まで記事を読んでくださりありがとうございます! 読者の皆さまにささやかながらクイズのプレゼントをお届けします。今日の記事の復習にぴったりですので是非解いてみてくださいね!
問1)以下の文の正誤を判定してください。
軌道というのはその名の通り電子が通る道のことなので、軌道上にのみ電子は存在し、軌道の内側にも外側にも電子は存在しない。
問2)オゾンのルイス構造式を示してください。
〈ヒント〉オゾンは酸素原子三つからなる分子です。まずは酸素原子二つをくっつけて酸素分子O2を作ってみましょう! あとは酸素分子と酸素原子をくっつければ完成です。O2の非共有電子対をじっと見つめると、なんだか出っ張っているように見えてきませんか?
問3)オゾンの共鳴構造を二つ示してください。
【連載 東京大学教養学部化学部寄稿 東大入試から学ぶ化学】











