東京大学教養学部化学部寄稿連載「東大入試から学ぶ化学」
(寄稿=東京大学教養学部化学部)
【問題】2017年第2問Ⅱより抜粋
硝酸は,過去には硝酸ナトリウムや硝酸カリウムに濃硫酸を加えて蒸留することで製造された。現在では,窒素から作ったアンモニアを酸化してNOを発生させ,これをさらに酸化したNO2を水と反応させるオストワルト法により製造される。NO2が発生する過程では,一部の⑦NO2同士が反応してN2O4を生じる。
問コ 下線部⑦のN2O4を生じる反応は,吸熱反応と発熱反応のいずれであるかを答え,その理由を,NO2の電子式に着目して簡潔に説明せよ。
【解答】
発熱反応 (理由)NO2は分子内に不対電子を持ち、エネルギーが高く不安定な状態である。N2O4に変化することで不対電子がなくなってエネルギーが低くなり安定化する。この過程は系の乱雑さが減少される反応であり、エネルギーが放出されるから。
(解答は東京大学教養学部化学部が作成)
【考察】
受験問題の解答としては、上記のように不対電子に着目した記述で十分でしょうが、ここではちょっとだけ踏み込んだ概念を導入して、この反応について考えてみたいと思います。
反応熱とエンタルピー
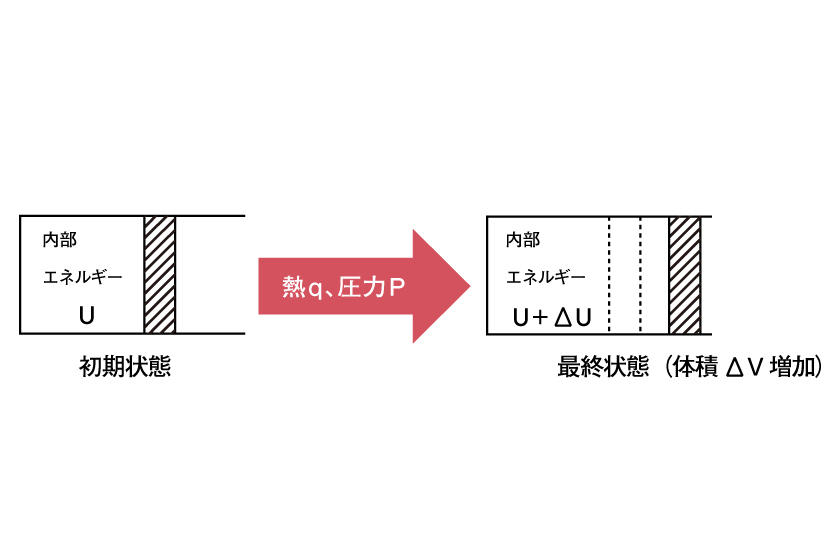
定圧過程で、以下の反応を考えることにします。
ここで、分子の伸縮運動や回転運動、並進運動のエネルギーをまとめて内部エネルギーUと定義し、気体が外界からされる仕事をWとすると、Uの変化量ΔU、W、気体が外界から受け取る熱量qの間には以下の関係式が成り立ちます。
ΔU=q+W
これを熱力学第一法則といいます。
熱力学第一法則は、
ΔU=q+w=q-PΔV ⇔ q=U+PΔV
ここでエンタルピーをH=U+PVと定義すると、定圧条件ではq=ΔHになります。つまりエンタルピーの変化は、定圧過程で系が吸収(放出)するエネルギーに等しくなります。標準状態において、標準物質から1 molの化合物を生成するときの反応熱をその化合物の標準生成エンタルピーΔfH゜といいます。化学反応における反応熱は、定圧条件下では反応エンタルピーΔrHに等しく、標準状態において、ΔrHは以下の式で表されます。
ΔrH゜=(生成物のΔfH゜の和)-(反応物のΔfH゜の和)
ΔrH゜>0のとき吸熱反応、ΔrH゜<0のとき発熱反応です。
NO2の二量化の反応熱
以上の定義を踏まえ、実際に
2NO2⇄N2O4
の反応熱について考えることにしましょう。NO2、N2O4の標準生成エンタルピーはそれぞれ33.2 kJ/mol、9.2 kJ/molです。標準状態において、正反応の反応エンタルピーは
ΔrH゜=9.2 kJ/mol-2×33.2 kJ/mol=-57.2 kJ/mol<0
となるので、NO2が二量化する過程は発熱反応であることがわかります。
冒頭の解答は、定性的な説明にとどまりやや定量性に欠く部分がありますが、以上のように定量的に説明すると、すっきりしますね。
せっかくの機会ですから、熱力学についてやや話を進めてみましょう。
エントロピー
さらに、自然現象が起こる方向性について新たな化学量を導入します。一般に自然現象は“乱雑さが増加する方向に進行する”と考えられていますが、その乱雑さの指標をエントロピーSで定義します。熱力学では、エントロピーを熱現象の方向性を決める状態量として、
S=qrev/T
と表します。ここでqrevは可逆変化において系が吸収する熱量、Tは系の温度です(系とは、反応に関与する物質の集合だと思ってください)。標準状態において、標準物質から1 molの化合物を生成するときのエントロピー変化をその化合物の標準生成エントロピーといいます。
ギブスエネルギー
化学反応は一般に一定温度、一定圧力の状況で行われますから、定温・定圧の環境でNO2の反応系を考えることにしましょう。この条件下で、以下の化学量を新たに定義します。
G=H-TS
このGをギブスエネルギーといいます。Hはエンタルピー、Tは反応温度、Sはエントロピーです。ギブスエネルギーの正負により、以下のような判断を行えます。
ΔG<0 : 反応は自発的に進行する
ΔG=0 : 反応は平衡状態にある
ΔG>0 : 反応は自発的に進行せず、逆反応が進行する
厳密には熱力学的な計算を要しますが、この判断を次のように説明することもできます。Hは反応熱ですから物質のエネルギーの大きさ、Sはエントロピーですから物質の乱雑さを表しています。化学反応はエネルギーが低く、乱雑さの大きい状態に向かって自発的に進行します。Hが小さいほど系はエネルギー的に安定であり、Sが大きいほど系は乱雑さが大きくなります。つまりこのとき反応は自発的に進行しやすく、ΔGは式の形から負になるということです。
反応の進行方向を考える指標として、ΔrGがあり、これを反応ギブスエネルギーと表すと、
ΔrG゜=ΔrH゜-TΔrS゜
と書けます。ΔrH゜は標準生成エンタルピー、Tは反応系の温度、ΔrS゜は標準生成エントロピーです。
以上の定義を踏まえ、実際に
2NO2→N2O4
について考えることにしましょう。一番最初にNO2だけを用意して放置した場合、実際に上の正反応は進行するのでしょうか。NO2、N2O4の標準生成ギブスエネルギーはそれぞれ51.3 kJ/mol、97.8 kJ/molです。正反応の反応ギブスエネルギーは
ΔrG゜=97.8 kJ/mol-2×51.3 kJ/mol=-4.8 kJ/mol<0
となり、負の値をとるため、たしかにNO2は二量化してN2O4へと変化していくことがわかります。不対電子に着目して説明された二量化も、このように定量的に確かめることができました。
(標準生成エンタルピー・標準生成ギブスエネルギーの数値は、国立天文台編「理科年表 2021」(丸善出版)によった)
【記事修正】2021年8月6日午後6時17分 解答作成者について追記しました。
【連載 東京大学教養学部化学部寄稿 東大入試から学ぶ化学】
【東京大学教養学部化学部寄稿】東大入試から学ぶ化学② ヨードホルム反応〈基礎編〉~有機反応の理解に役立つ化学の基礎知識~