浅見仁太さん(薬学系・博士3年)、清水敏之教授(同研究科)らの研究チームは、B型肝炎ウイルスが肝細胞表面に結合する際に標的となるヒトの膜タンパク質(NTCP)の立体構造を世界で初めて解明した。B型肝炎ウイルスの感染機構のさらなる解明、新規治療薬の開発への貢献が期待される。成果は5月17日付の英国科学雑誌『Nature』で掲載された。
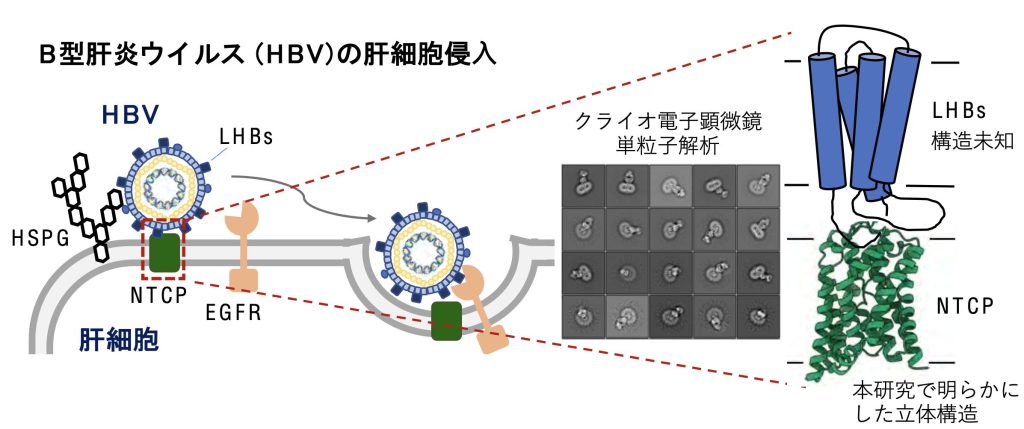
B型肝炎ウイルス(HBV)は肝硬変や肝細胞がんを引き起こす主要な原因で、感染者は世界に約2.9億人いるとされる。肝細胞の基底膜に多量にあるNTCPは、小腸で再吸収された胆汁酸を肝臓に取り込むタンパク質だ。2012年には、HBVの肝細胞表面への吸着を仲介して肝細胞への侵入に関わることが報告されていた。しかし、NTCPの立体構造はこれまで不明であり、HBVの細胞内侵入の詳しいメカニズムについての情報が不十分だった。
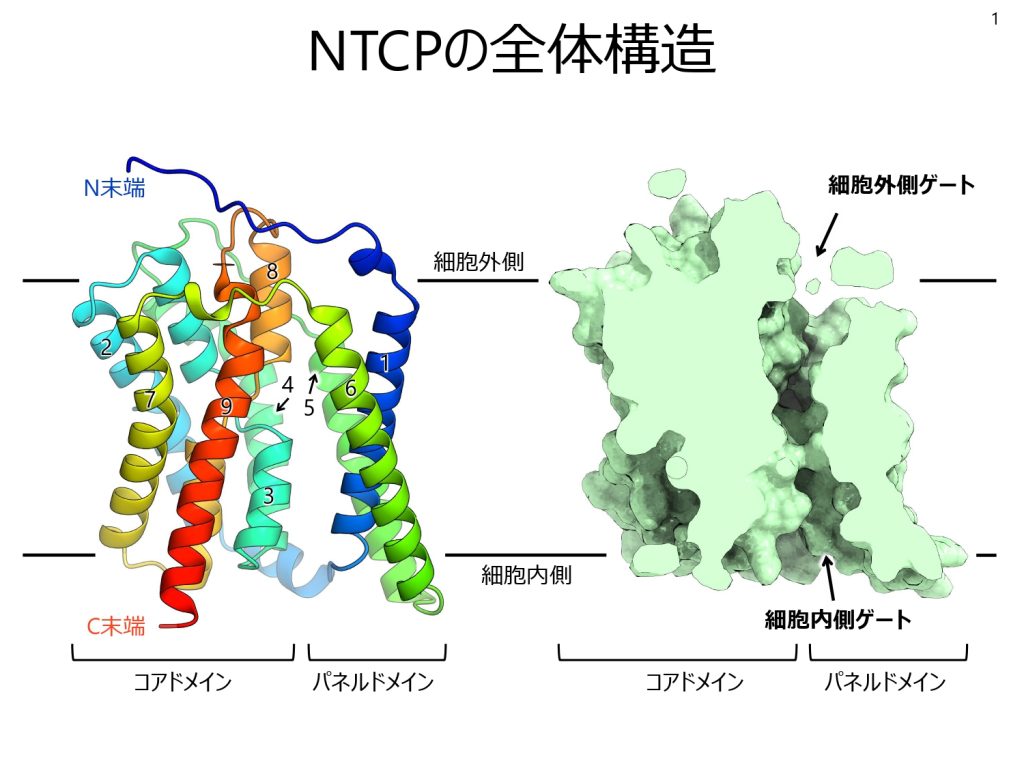
浅見さんらの研究チームは培養細胞からヒト、ウシ、ラットのNTCP精製に成功。独自に作製したNTCP構造を認識する抗体Fabとの複合体を調製し、東大のクライオ電子顕微鏡を用いて立体構造を解明した。NTCPが9本の膜貫通αヘリックスと呼ばれるタイプのタンパク質から成り、「コアドメイン」と「パネルドメイン」という二つの構造を作ることが分かった。二つの構造間には疎水性のトンネル構造があり、輸送される胆汁酸の通り道だと考えられる。
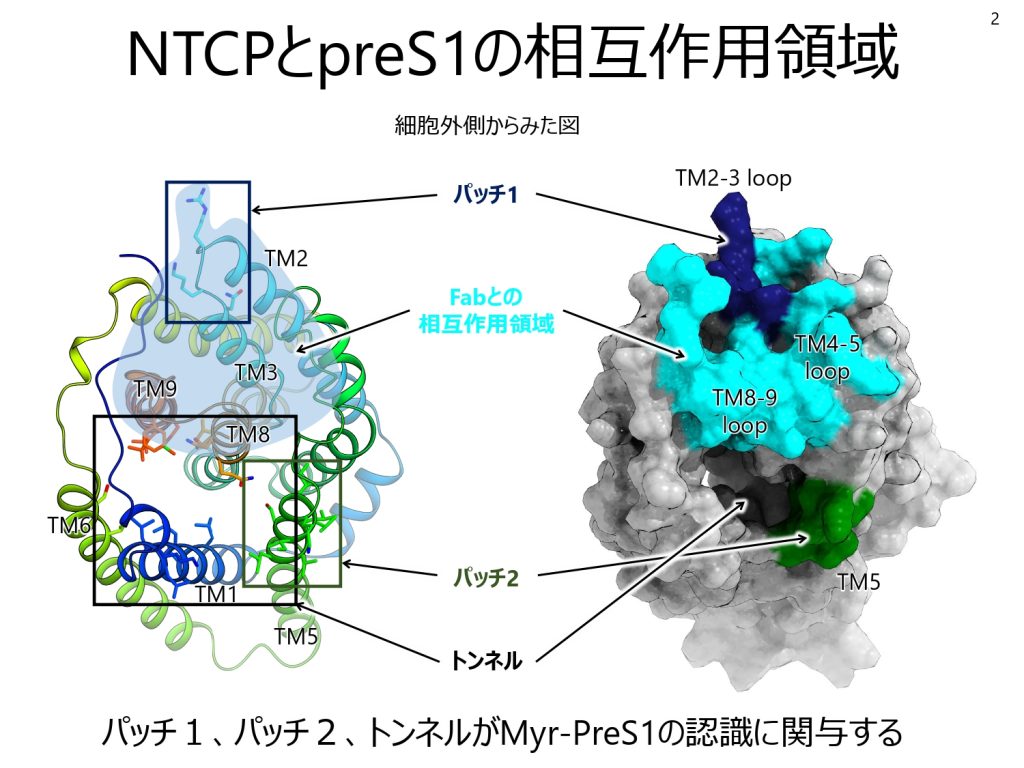
同チームはHBVとNTCPの結合のメカニズムにも迫った。HBV表面のタンパク質でNTCPとの結合に必須な構造を模倣して人工合成した「ミリストイル化PreS1ペプチド」を使用。同じくクライオ電子顕微鏡を用いて、胆汁酸の輸送経路であるNTCPのトンネル構造に一部分が結合することが示唆された。HBVの表面タンパク質のミリストイル化PreS1領域がNTCPのトンネル構造に特異的に結合することで、HBVの肝細胞への安定な吸着が起こると考えられる。
HBVの治療薬として現在広く用いられている核酸アナログ製剤(ウイルスの増殖を直接抑える薬剤)とインターフェロン製剤(感染細胞の作るタンパク質によってウイルスのはたらきを阻害する薬剤)では体内からのHBV完全排除ができない。NTCPはHBVの細胞内侵入に必須なため、今回の成果から、立体構造を基づいた治療薬の分子設計という新しいアプローチが可能になる。肝移植でのHBV感染予防、わずかに残存するHBVの再活性化の予防ができる抗HBV薬の開発へ期待がかかる。









