平井隼人特任研究員、太田邦史教授(ともに東大大学院総合文化研究科)らの研究グループは、分裂酵母が栄養飢餓になるとRNA干渉を受けてリボソームの遺伝子領域が発現しなくなることを発見した。成果は現地時間10月31日付で米科学雑誌『Cell Reports』に掲載された。
分裂酵母はヒトと細胞の作りが似ており、遺伝に関わる実験に適したモデル生物。リボソームは全ての生物において同じ役割を担う、タンパク質を合成する装置。RNAはDNAの写しで、生命活動のリアルタイムな制御に関わり、リボソームは全RNAの8割を占める「rRNA」と複数のタンパク質から作られる。RNAにはrRNA以外にも多くの種類があり、そのうちの一つにほとんど全てのタンパク質の設計図になるmRNAがあり、ほとんど全てのタンパク質はmRNAの情報をもとにしてリボソームで合成されている。「RNA干渉」はsiRNAというタンパク質の設計図とならないRNAによる現象。siRNAは種類ごとに特定のDNA領域を凝集させ、RNAの転写が抑制される。DNAがRNA合成される状態かどうかは、凝集しているかどうかで観察ができる。飢餓状態でrRNAが合成されるrDNA領域が凝集することは知られていたが、その仕組みは不明だった。
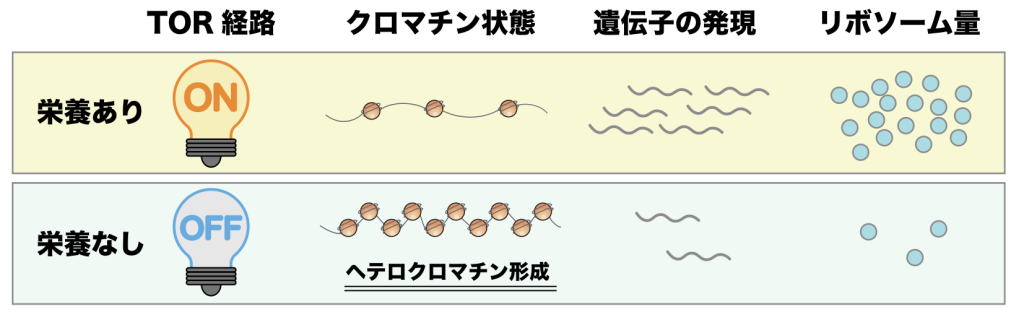
平井特任研究員らは栄養に関する情報伝達を行う細胞内の「TOR経路」に着目した。TORは「Target of Rapamycin」(抗腫瘍・免疫抑制剤ラパマイシンの標的)の略で、TORの関わる細胞内の情報伝達経路は外部環境の栄養不足に反応して不活性化する。十分な栄養がある条件下で人為的にTOR回路を不活性化できる分裂酵母の変異体を観察したところ、rDNAがRNA干渉で凝集し、rRNAの合成が抑制されていた(図)。栄養不足のときにTOR経路を不活性化しrDNAを凝集させることで、RNAのうち大きな割合を占めるrRNAの合成を抑え、細胞全体のエネルギー消費を抑えていることが示唆された。
今回明らかになった分裂酵母での仕組みは、ヒトに近い機構であることが予想され、栄養飢餓に対してのヒトの体内応答にも通じるメカニズムを見出すことに成功したと言える。ヒトにもTOR経路はあり、がん細胞では異常に活性化することが知られている。リボソームも過剰に合成されているため、両者の関わりが明らかになることで新たながん治療薬の開発に貢献することが期待される。










