但馬聖也さん(博士課程)、加藤英明准教授(ともに東大大学院総合文化研究科)らの研究グループは、東大物性研究所、名古屋工業大学、米スタンフォード大学との共同研究で光に反応してカリウムイオンを細胞外に輸送するタンパク質(KCR)の立体構造・作動機構を解明した。実験動物の神経活動を非侵襲的に観察するツールや遺伝子治療への応用が期待される。成果は現地時間8月30日付で米科学雑誌『Cell』オンライン版に掲載された。
KCRは光を受容するタンパク質「ロドプシン」の一種で、細胞内外を仕切る細胞膜に存在し、カリウムイオンを選択的に細胞外へ輸送する機能を持つ。光受容でイオン輸送を行うロドプシンを使うことで、標的の細胞膜が帯びる電荷(膜電位)を光で制御することが可能なため、神経科学をはじめ、疾患の遺伝子治療への応用が期待されている。神経活動は、細胞外へのカリウムイオンの流出によって膜電位が負に偏ることで抑制されるため、カリウムイオンを輸送するロドプシンがあれば、標的細胞の機能に抑制作用をもたらす理想的なツールとしての応用の可能性があった。ようやく昨年に微生物からKCRが発見されたものの、どのようにカリウムイオンを輸送するのかは完全に不明だった。
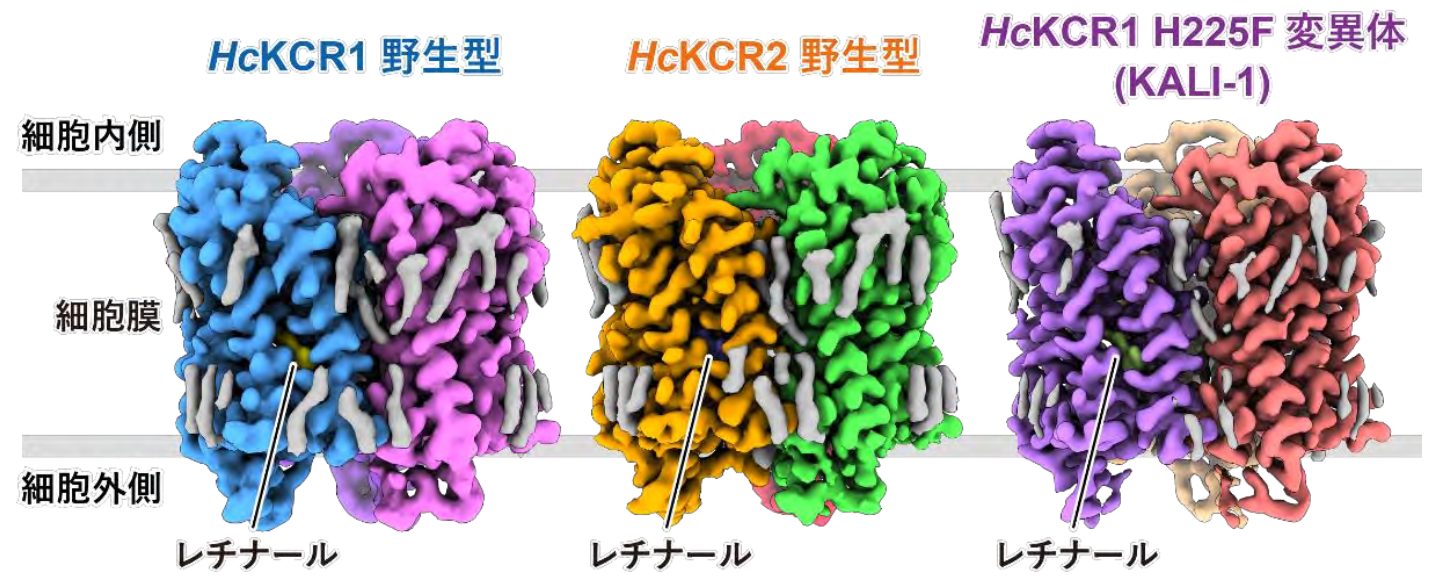
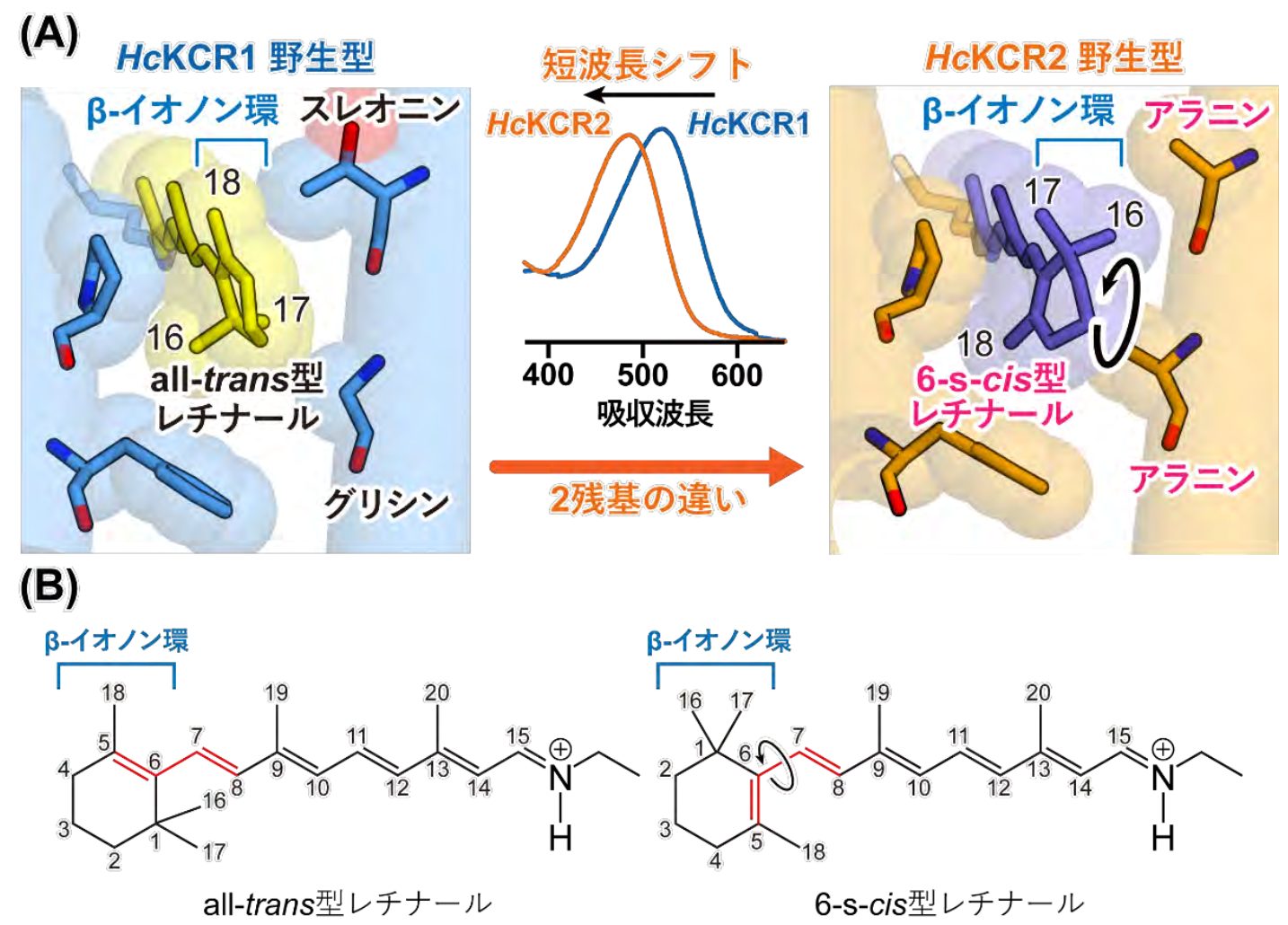
但馬さんらはクライオ電子顕微鏡を用いて微生物から得られた2種のKCRと、カリウムイオンをより輸送しやすく改変した変異体KCRの立体構造を観察。一般的なロドプシンに見られるように、内部にあるレチナールという分子が光を受容すると構造が変化し、タンパク質全体の構造に変化をもたらすことが分かった(図1)。二つの野生型のKCRはそれぞれ受容する光の波長が異なっているが、それはレチナール分子の構造に違いがあることと、周囲のアミノ酸の構成が異なることが理由だとも考察された(図2)。
また、従来のカリウムイオンを輸送するタンパク質として代表的なカリウムイオンチャネルKcsAの構造と今回観察したKCRの構造を比較。報告されていたカリウムイオンチャネルは、構成アミノ酸の連なった単位が二つや四つ合わさって多量体構造を形成し、間にカリウムイオンを通す経路を有していた。経路に露出しているアミノ酸は、カリウムイオンの高い選択性での輸送を実現する対称性を多量体同士で持っていることも観察されていた。しかし、KCRでは3量体の間ではなく、それぞれの単位にカリウムイオンを通す経路があり、細胞外側に露出した特定の種類のアミノ酸がカリウムイオンを選択的にタンパク質内部へ輸送するフィルターになっていることが分かった(図3)。
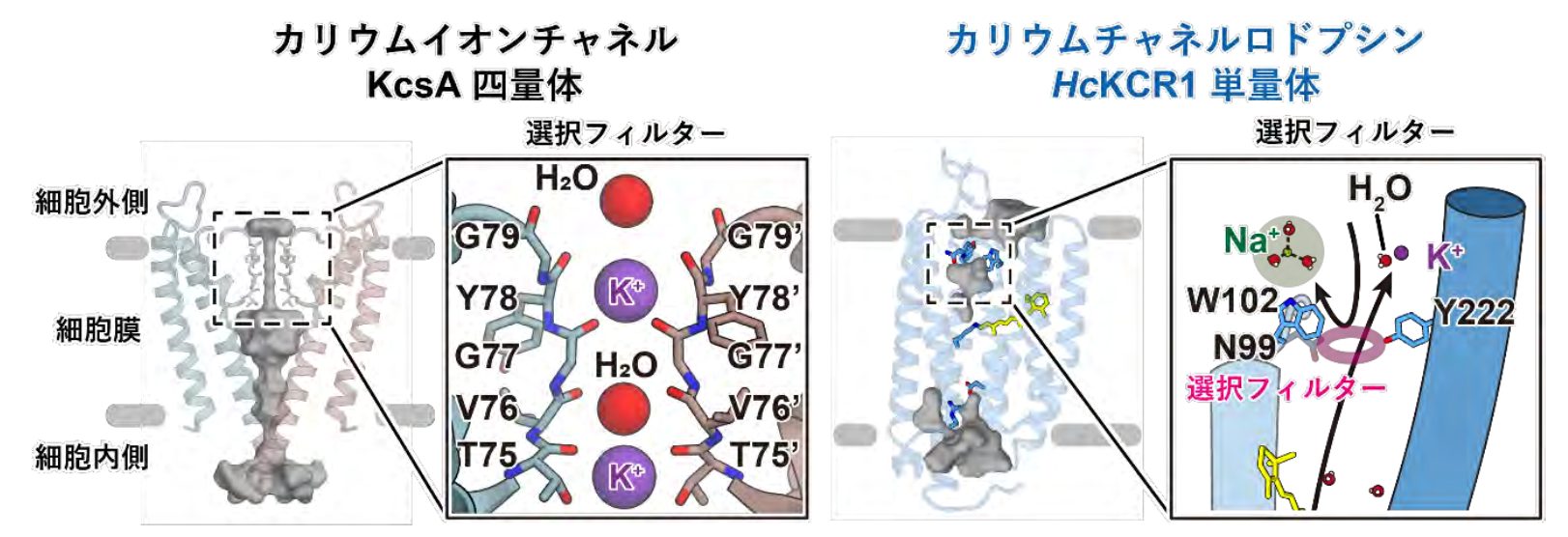
続いて但馬さんらは、KCRを挟んだ細胞内外のイオン組成を変えて反対向きの細胞内側へ輸送しようと試みたが、カリウムイオンは選択的に透過されなかった。解析を進めると、これはKCRの細胞内側の構造に、イオンに水和した水分子を細胞外へ到達するまでに剥がし、細胞外側にあるフィルター構造を透過しやすくする仕組みがあるからだと明らかになった。脱水和したイオンのみがKCRの細胞外側の構造にアクセスできるため、細胞外に多いナトリウムイオンやカルシウムイオンなどは透過できず、カリウムイオンのみが細胞内から排出される仕組みが実現されていると但馬さんらは結論付けた。
但馬さんらは、よりカリウムイオンを透過させやすい改良型KCRであり、従来よりも効率的に神経活動を抑えることができるツールとして「KALI」を開発。更なる神経科学の理解や遺伝子治療における遺伝子発現制御法の発展への貢献が期待される。









